
PAR

Ce cours est constitué de deux parties. La première partie aborde des notions normalement déjà connues par le préparant niveau 4, sauf en ce qui concerne la loi de Charles. Les notions abordées ici ne sont donc pas développées. Il s'agit d'un rappel. Dans la pratique, cette première partie s'accompagne d'exercices et d'exemples au tableau, et sous forme de travaux pratiques d'une durée de deux heures environ.
Unités de force : 1 daN = 1 kgf
N : abréviation de Newton
daN : abréviation de déca Newton = 10 Newton
kgf : abréviation de kilogramme force. Unité désuette mais adpatée pour comprendre les notions dont nous avons besoin en plongée.
L'expérience de Torricelli :
Evangelista TORICELLI (1608 - 1647) : Physicien italien, en 1643 il monte une expérience qui a permis de mesurer la pression atmosphérique.
L Mais quelle idée qu'il a eue de faire ça avec du mercure !

Unités de pression : 1 bar = 1 kg/cm2 = 1 atm = 100 000 Pa = 100 kPa = 1000 hPa = 760 mm Hg (mm de mercure)
bar : abréviation de bar
atm : abréviation de atmosphère
kg/cm2 : abréviation de kilogramme par centimètre carré
Pa : abréviation de Pascal (kPa = kilo Pascal, hPa =hecto Pascal)
mm Hg : abréviation de millimètre de mercure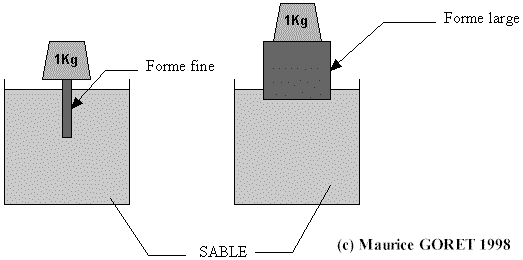
P=F/S
La pression est égale à une force divisée par une surface.
Applications :
Le matériel
(fonctionnement de détendeurs/ réserves, etc).
Les effets des variations de pressions sur l'organisme du plongeur.
Le gonflage des blocs.
II) Masse volumique et densité Rappel sur les unités de volume : 1 m3 = 1000 dm3
La masse volumique d'un objet est le rapport de la masse de l'objet par son volume. Lorsqu'un objet est homogène (constitué partout du même matériau) sa masse volumique est constante. L'unité de masse volumique est le kg/m3. Mais nous utiliserons plus souvent le kg/dm3 ou kg/l.
La densité d'un objet est le rapport de sa masse volumique par celle d'un élément de référence dont la densité est alors 1. Cet élément est l'air pour les gaz, l'eau pour les solides et les liquides. La densité étant un rapport de masse volumique, elle n'a pas d'unité.
Cependant, dire qu'un objet a une masse volumique de 8 kg/l signifie que pour un volume d'un litre sa masse est de 8 kg. Et sa densité vaut 8.
ARCHIMEDE (287 -212 av. JC) : Né à Syracuse en Sicile, il aurait pu y couler des jours tranquilles. Oui, ben voilà, il était passionné de mathématiques et de physique, et était bourré de principes. On lui prête l'invention de bon nombre de choses utiles encore à nos contemporains, comme : le palan, le levier (non, pas le levier de vitesse!), les engrenages (normal à force de se faire des noeuds au cerveau), le téléphone portable et l'internet (enfin, pour ces deux points je n'en suis pas trop sûr). C'est d'ailleurs lorsqu'il inventa la carte de crédit qu'on pense qu'il découvrit son fameux principe. En effet suite à cette expérience il déambula plusieurs jours sans dessoûler dans les rues de Syracuse en criant à qui voulait l'entendre "eurocard eurocard" (j'ai trouvé, j'ai trouvé). Mais comme on n'avait pas encore inventé le distributeur de billets les gens ne virent pas l'utilité de son invention, et l'histoire de la plongée retint son nom pour la poussée du même nom. (Là encore, ça reste à vérifier). Grâce à lui, les plongeurs ne plongent plus idiots.
Pour lui rendre hommage rappelons que son fameux principe qui nous oblige à placer des plombs autour de notre taille est depuis devenu un théorème (il se démontre).
| Tout corps plongé dans un liquide reçoit de la part de ce liquide une poussée verticale dirigée de bas en haut égale au poids du volume de liquide déplacé. |
Applications :
Le lestage.
Le poumon ballast
La bouée ou le gilet
Robert BOYLE (1627-1691) : Cet irlandais est considéré comme le "père de la chimie". Il est surtout connu pour ces travaux sur les gaz. Il a trouvé que l'air avait une masse. En 1670, il est le premier à détecter la présence de bulles dans le sang d'animaux morts.
Edme MARIOTTE (1620-1684) : Français J , Mariotte était moine L . Il complète en 1976 les travaux de Boyle sur la compressibilité des gaz. C'est en effet grâce à lui que tous les ans des candidats au PN4 perdent bêtement des points en théorie en oubliant de préciser que tout se passe à "température donnée". Merci Edme.
A température constante le volume d'un gaz est inversement proportionnel à la pression qu'il subit. |
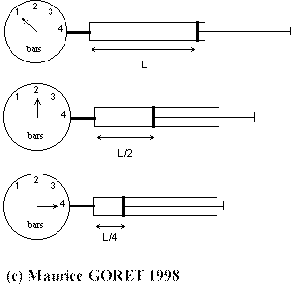
Plus la pression vue par un gaz est importante, plus son volume est faible.
Formules :
P1V1 = P2V2 = ...........= PnVn = Cste |
Applications :
Le gonflage des blocs.
L'influence des variations de volume des gaz sur l'organisme.
V) La loi de Charles
Jacques CHARLES (1746-1823) : Physicien français J , il est le premier à avoir l'idée d'utiliser l'hydrogène pour gonfler les aérostats. Il complète en 1976 les travaux de Boyle sur la compressibilité des gaz. On n'a pas idée. Car c'est de là qu'il s'est intéressé à la variation de la pression des gaz en fonction de la température dans un volume constant.
A volume constant la pression d'un gaz est proportionnelle à la température qu'il subit. |
A volume constant, plus la température à laquelle est soumis un gaz est importante, plus sa pression est forte.
Formules :
P1/T1 = P2/T2 = ........= Pn/Tn = Cste |
Dans cette formule, la température doit être exprimée en .... KELVIN.
T° K = T° C + 273 |
La température en Kelvin est égale à la température en degré Celsius (souvent mal nommé degré centigrade) plus 273.
Applications : Le gonflage des blocs.
John DALTON (1766 -1844) : Britannique. A l'origine du daltonisme (si si, là c'est vrai), il s'est en autre intéressé aux mélanges des gaz. (L'histoire ne dit rien sur les mélanges des liquides).
| La pression d'un mélange de gaz est égale à la somme des pressions qu'aurait chaque constituant du mélange s'il était seul dans l'espace occupé par le mélange. |
Définition :
La pression partielle d'un constituant d'un mélange de gaz est la pression qu'aurait ce constituant s'il était seul dans l'espace occupé par le mélange.
Formules :
Ptot = Pp1 + Pp1+ ...........+ Ppn
Ppn = %n Ptot
La pression d'un mélange de gaz est égale à la somme des pressions partielles de chacun des gaz.
La pression partielle d'un constituant d'un mélange de gaz est égale au pourcentage de ce constituant dans le mélange multiplié par la pression du mélange.
Applications :
L'influence des variations des pressions
partielles du mélange respiré sur l'organisme.
La plongée aux mélanges